通过将多肽与另一种分子(例如化疗药物或诊断成像剂)结合,所得分子可以特异性靶向表达受体的细胞,使得PDC成为肿瘤治疗和诊断的新模态。
01
PDC的特征及抗肿瘤功效
PDC的靶向机制与许多因素有关,受体的功能决定作用机制。与ADC(抗体-药物偶联物)类似,归巢肽靶向细胞膜表面,触发受体介导的药物内吞作用和内化作用。PDC和ADC在概念上相似,但具有截然不同的结构和属性。抗体具有更高的特异性和更长的半衰期,而归巢肽具有更好的载药效能和组织穿透能力。PDC和ADC的比较如表1所示。
表1.PDC与ADC的属性对比

PDC中使用的肽可分为两类:细胞穿透肽(CPP,cell-penetratingpeptides)和细胞靶向肽(CTP,cell-targetingpeptides)。
CPPs跨细胞膜的摄取机制尚不完全清楚。据报道,一些CPP通过能量依赖性细胞过程(如内吞作用或受体介导的摄取)穿过细胞膜,而其他CPP使用能量独立的非内吞易位途径。然而,由于其低细胞特异性,CPPs的广泛应用受到限制。相反,CTP是理想的载体分子,因为它们具有与mAb类似的能力。它们以高亲和力结合肿瘤细胞表面过度表达的受体。
尽管两种多肽-药物偶联物已被FDA批准用于治疗和诊断癌症,但针对过表达受体的新型肽-药物偶联物的开发仍然非常具有挑战性。
02
PDC靶向受体与接头
PDC最常靶向的受体包括:
整合素(Integrins)
表皮生长因子受体(EGFR,EpidermalGrowthFactorReceptors)
G蛋白偶联受体(GPCR,GProtein-CoupledReceptors)
神经肽Y受体(NPYR,neuropeptideYReceptors)
铃蟾肽受体(BombesinReceptor)
生长抑素受体(SSTR,SomatostatinReceptors)
PDC结构中的常见接头主要类型以及裂解方式包括:
腙(Hydrazone);裂解方式:酸解

二硫键化合物(Disulfide);裂解方式:还原
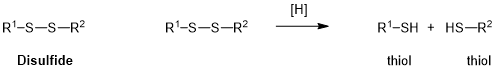
偶氮化合物(Azo);裂解方式:还原
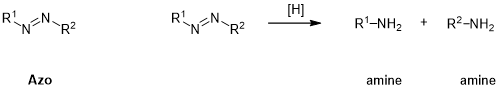
酯(ester);裂解方式:酸碱催化水解或酶解
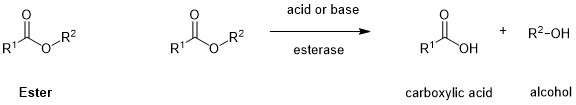
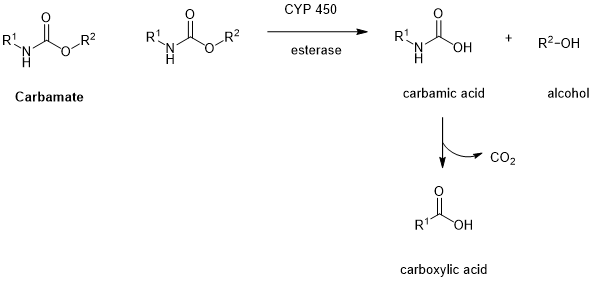
氨基甲酸酯(carbamate);裂解方式:酶解
酰胺(Amide);裂解方式:酶解
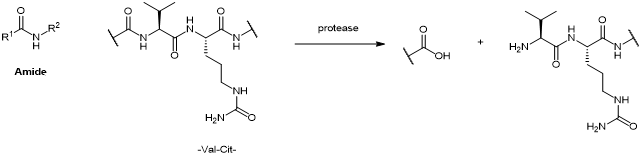
03
PDC主要载荷
每个PDC的核心都是细胞毒性治疗剂载荷。多肽载体和接头结构提供了PDC的选择性,但药物是实现PDC功效的全部希望。
在许多情况下,PDC中的“药物”是指细胞毒性(化疗)抗癌剂,但也可以指广谱的活性治疗成分。放射性核素与肽的结合,可以产生癌症诊断或PRRT(肽受体放射性核素治疗,peptidereceptorradionuclidetherapy)的分子。此外,硼等非放射性分子可用作载荷,以生成硼中子俘获疗法(BNCT)的PDC。PDC中经常使用的载荷包括:
3.1化疗药物
目前有超过250种FDA批准的药物用于治疗恶性肿瘤(参见Cancer.gov),这些经典的化学治疗药物很多由于其强大的细胞毒性而具有很强的药理活性。
结合DNA的化疗药物
PDC中使用的化疗药物可根据其一般作用方式进行分类。第一组分子与细胞DNA或DNA-蛋白质复合物结合并相互作用,因此转录和DNA复制受到干扰,实现细胞凋亡的诱导。
这些药物包括金属络合物、喜树碱(CPT,Camptothecin)、蒽环类药物,诸如柔红霉素(DAU,daunorubicin)和多柔比星(DOX,doxorubicin)等(图1),这些高效分子被广泛应用在PDC中。例如靶向SSTR2(生长抑素受体2)的奥曲肽(octreotide)通过酯连接体与DOX或2-吡咯啉-DOX偶联,并在体内对靶向肿瘤细胞表现出选择性毒性。
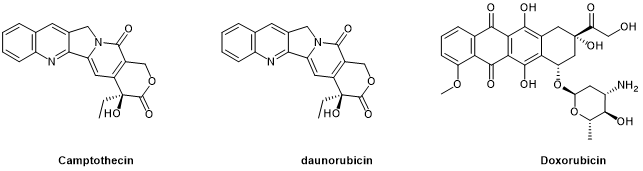
图1.通过结合DNA起效的化疗小分子药物Camptothecin(喜树碱),daunorubicin(柔红霉素)和Doxorubicin(多柔比星)化学结构
抑制DNA合成化疗药物
第二类经常使用的细胞毒素化合物,通过抑制DNA生物合成来实现细胞毒性。这些与天然代谢物结构相似的抗代谢物(antimetabolite),例如脱氧胞苷的核苷类似物吉西他滨(gemcitabine)或抑制二氢叶酸还原酶的叶酸衍生物甲氨蝶呤(MTX,methotrexate)(图2),在抗癌细胞过程中表现出强大的效力。
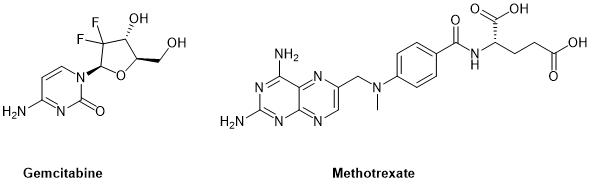
图2.抗代谢物细胞毒素化合物Gemcitabine(吉西他滨)和Methotrexate(甲氨蝶呤)化学结构
抗有丝分裂剂
第三组化学治疗剂由作用于微管的抗有丝分裂剂(anti-mitoticagents)组成。例如抑制微管解聚的紫杉醇(PTX,paclitaxel,图3)和抑制微管蛋白聚合的长春花生物碱类似物。
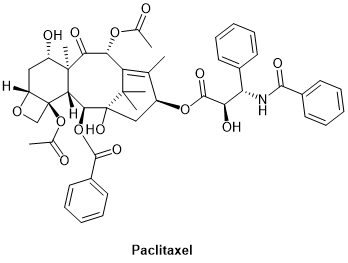
图3.紫杉醇化学结构
3.2放射性核素
化疗药物中,放射性核素是PDC中的第二大有效载荷组,可用于与癌症相关的诊断和治疗两大模态。标记有正电子发射放射性同位素的PDC,如氟18(18F)、铜64(64Cu)和镓68(68Ga)可以用作PET(正电子发射断层扫描)显像剂,标记有伽马射线放射性同位素的PDC,例如锝99m(99mTc)和碘123(123I),可用于单光子发射计算机断层扫描(SPECT)。通过与肿瘤细胞上的靶向受体结合,可以精确定位恶性组织。
除了诊断方法外,如果使用β发射核素、俄歇电子发射(Augerelectron-emitting)核素或α发射核素,也可以在治疗环境中使用放射性核素标记的PDC治疗肿瘤。
放射性核素的选择在很大程度上取决于目标肿瘤或转移灶的大小。最常用的放射性核素是铟111(111In)、钇90(90Y)和镥177(177Lu)。迄今为止最成功的治疗性肽放射性药物是177Lu-DOTA-TATE。在晚期中肠神经内分泌肿瘤患者中,与高剂量奥曲肽长效可重复治疗相比,177Lu-DOTA-TATE治疗可获得更长的无进展生存期和显著提高的缓解率。
欧盟委员会于2017年10月批准了177Lu-DOTA-TATE(Lutathera®),2018年1月获得了FDA的批准。这一进展证明了受体介导的药物递送方法在癌症治疗中的巨大潜力,被认为是该领域肽基医学和个性化医学道路上的一个重要里程碑。
04
PDC市场分析
4.1PDC全球市场推动因素
慢性病患病率增加
癌症、糖尿病和自身免疫性疾病等慢性疾病,由于其复杂的性质以及难以靶向特定细胞或组织,通常难以使用传统药物治疗。
多肽-药物偶联物提供了一种更有针对性的治疗方法,可以更精确地递送药物有效载荷并降低副作用的可能性。慢性病的日益流行正以多种方式推动多肽-药物偶联物的开发和使用。
据世界卫生组织称,慢性病约占全世界所有死亡人数的71%,仅心血管疾病每年就造成1790万人死亡。同样,美国医院协会报告称,约有1.33亿美国人(占总人口的近50%)患有至少一种慢性疾病,例如心脏病、高血压或关节炎。这一数字在过去十年中增加了1500万,预计到2030年将增加到1.7亿。
研发活动增加
制药行业正在大力投资多肽药物的研发,引领了新药和创新药物的发展。各大制药公司正在投入大量资金研究和开发多肽药物偶联物。
4.2PDC主要趋势
靶向治疗需求上升
对靶向治疗的需求不断增长是全球多肽-药物偶联物市场的主要趋势之一。
更精确的靶向疗法的开发,可以使一系列疾病得到更有效和更安全的治疗,例如乳腺癌,由于其非选择性性质,传统的乳腺癌化学疗法通常会引起不良副作用。多肽-药物偶联物已显示逐渐成为乳腺癌靶向治疗的选择。
4.3PDC开发协作与伙伴关系
制药公司之间的协作和伙伴关系在PDC的开发中变得越来越普遍。这些伙伴关系使公司能够利用各自的专业知识和资源来加速新疗法的开发。例如BicycleTherapeutics和Genentech合作开发新的肽基癌症疗法,将Bicycle在多肽药物偶联物方面的专业知识与Genentech在肿瘤学研发方面的专业知识结合起来。
阿斯利康(AstraZeneca)和BicycleTherapeutics也达成了合作关系,共同开发用于呼吸系统和心血管疾病的PDC,融合了阿斯利康(AstraZeneca)在药物开发和商业化方面的专业,以及Bicycle在PDC方面的专业。
Ipsen和EpiVaxOncology合作开发新的肽基的癌症疗法;辉瑞和GlycoMimetics同样实现了合作,共同开发肽基药物的血液疾病疗法。
4.4PDC模态
全球PDC市场可分为治疗性和诊断性。由于对治疗各种疾病的靶向疗法的需求不断增加,治疗领域目前在市场上占据主导地位。
肿瘤学:由于肿瘤学领域对肽基疗法的高需求,肿瘤PDC治疗领域占据了市场主导地位。
代谢紊乱:PDC被用于治疗代谢紊乱,如糖尿病和肥胖症。
心血管疾病:PDC开发用于治疗心血管疾病,例如高血压和心力衰竭。
传染病:PDC也在治疗艾滋病和肺结核等传染病领域得到应用。
4.5PDC市场区域特点
从地理角度来看,北美一直是全球PDC市场的主导区域,主要因素包括:
成熟的制药公司:北美是一些世界上最大的制药公司的所在地,这些公司在多肽药物偶联物的开发上投入了大量资金。这些公司拥有资源和专业知识,可以在最佳周转时间内将新疗法推向市场。
慢性病高发:北美地区癌症、糖尿病、心血管病等慢性病高发,需要长期治疗。多肽药物偶联物提供有针对性和个性化的治疗选择,使其成为患者和医疗保健提供者的首选。
有利的监管环境:监管机构已经为PDC的审批制定了明确的指南和流程,制药公司更容易将新产品推向市场。
亚太地区是全球多肽药物偶联物市场增长最快的部分,主要因素包括:
对靶向治疗的需求不断增长:由于慢性病患病率上升以及对更有效和更安全治疗的需求,亚太地区对靶向治疗的需求正在增加。
增加对医疗保健的投资:亚太地区的政府和私人组织正在大力投资医疗保健基础设施和研发。这项投资推动了一系列疾病的创新疗法的开发,包括多肽-药物偶联物。
有利的监管环境:亚太地区的监管环境越来越有利于多肽药物偶联物的开发和商业化。监管机构正在为批准这些疗法制定更明确的指南和流程,使制药公司更容易将新产品推向市场。
预计2023年全球多肽药物偶联物市场规模为8.6亿美元,全球PDC市场2022年至2030年的复合年增长率(CAGR)预计为13.7%。
4.6PDC重要参与者
PDC市场的重要参与者包括:
NovartisAG,AstraZeneca,BicycleTherapeutics,CybrexaTherapeutics,EsperancePharmaceuticals,OncopeptidesAB,PepgenCorporation,SoricimedBiopharma,Theratechnologies,PfizerInc,ValidusPharmaceuticalsLLC,AntisenseTherapeutics,MidatechPharmaPLC,IpsenPharma,ChiasmaInc.,PeptronInc.,CrineticsPharmaceuticals,DauntlessPharmaceuticals,CamurusAB,TevaPharmaceuticalsInc.,Pharmaspur,AspireoPharmaceuticals,IonisPharmaceuticalsInc,MidatechPharmaPlc等。
参考资料:
[1]He,Q.etal.Tumormicroenvironmentresponsivedrugdeliverysystems.AsianJPharmSci.2020,15,416-448.
[2]Jin,Y.etal.Newtechnologiesbloomtogetherforbetteringcancerdrugconjugates.PharmacolRev.2022,74,680-711.
[3]Vrettos,E.I.etal.Developmentofprogrammablegemcitabine-GnRHpro-drugsbearinglinkercontrollable“click”oximebondtethersandpreclinicalevaluationagainstprostatecancer
EurJMedChem.2021,211,Article113018.
[4]Wang,J.Targeteddeliveryofaligand‒drugconjugateviaformylpeptidereceptor1throughcholesterol-dependentendocytosis.MolPharm.2019,16,2636-2647.
[5]Sangtani,A.etal.Nanoparticle-peptide‒drugbioconjugatesforunassisteddefeatofmultidrugresistanceinamodelcancercellline.BioconjugateChem.2019,30,525-530.
[6]Fu,C.etal.Peptide–drugconjugates(PDCs):anoveltrendofresearchanddevelopmentontargetedtherapy,hypeorhope?ActaPharmaceuticaSinicaB.2023,13,498-516.
[7]Thorén,P.E.G.etal.Membranedestabilizingpropertiesofcell-penetratingpeptides.Biophys.Chem.2005,114,169–179.
[8]Weidmann,A.G.etal.Targetedchemotherapywithmetalcomplexes.CommentsMod.Chem.ACommentsInorg.Chem.2014,34,114–123.
[9]Wall,M.E.etal.Camptothecinandtaxol:fromdiscoverytoclinic.J.Ethnopharmacol.1996,51,239–254.
[10]Minotti,G.etal.Anthracyclines:molecularadvancesandpharmacologicdevelopmentsinantitumoractivityandcardiotoxicity.Pharmacol.Rev.2004,56,185–229.
[11]Engel,J.B.etal.Targetedtherapywithacytotoxicsomatostatinanalog,AN-238,inhibitsgrowthofhumanexperimentalendometrialcarcinomasexpressingmultidrugresistanceproteinMDR-1.Cancer.2005,104,1312–1321.
[12]Galmarini,C.M.etal.Nucleosideanaloguesandnucleobasesincancertreatment.LancetOncol.2002,3,415–424.
[13]Chan,E.S.L.etal.Mechanismsofactionofmethotrexate.BullHospJtDis.2013,71,5–8.
[14]Xiao,H.etal.InsightsintothemechanismofmicrotubulestabilizationbyTaxol.Proc.Natl.Acad.Sci.U.S.A.2006,103,10166–10173.
[15]Zhou,X.J.etal.Preclinicalandclinicalpharmacologyofvincaalkaloids.Drugs.1992,44,1–16.
[16]Bhattacharyya,S.etal.Metallicradionuclidesinthedevelopmentofdiagnosticandtherapeuticradiopharmaceuticals.DaltonTrans.2011,40,6112–6128.
[17]Thundimadathil,J.Cancertreatmentusingpeptides:currenttherapiesandfutureprospects.J.AminoAcids.2012,967347.
[18]Strosberg,J.etal.Phase3trialof177Lu-dotatateformidgutneuroendocrinetumors.N.Engl.J.Med.2017,376,125–135.
[19]Shivarkar,A.etal.TheGlobalMarketLandscapeForPeptideDrugConjugates.BioprocessOnline.17,03,2023.







